Lý thuyết về pH
Khái niệm pH
pH chỉ thị mức độ axit hoặc bazo của một dung dịch. Độ pH thay đổi từ 0 đến 14 pH khi chúng ta đo trong môi trường nước. Dưới pH 7, dung dịch có tính axit. Trên giá trị này, dung dịch có tính kiềm. Khi pH bằng 7, dung dịch trung tính.
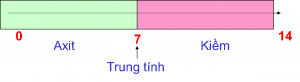
Khái niệm pH đã được giới thiệu vào năm 1909 bởi nhà hóa học người Đan Mạch Sorensen. pH là từ viết tắt của Pondus Hydrogeni.
pH có thể được biểu diễn bằng phương trình pH = – log [H+]
pH được định nghĩa là trừ 1 nhân với log thập phân của nồng độ mol ion hydro trong dung dịch lỏng, đưa ra chỉ thị nồng độ H + trong dung dịch: [H+] = 10-pH. pH cho phép biểu thị nồng độ thấp của H+ hoặc OH–. Ví dụ: pH = 4 tương ứng với 10-4 mol/L H+ hoặc 10-10 mol/L OH–.
Thang đo pH
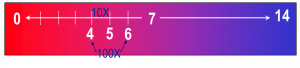
Vì pH là hàm log (thang đo logarit của tính axit), sự khác biệt trong 1 đơn vị pH là sự khác biệt 10 lần trong nồng độ ion hydro (hoặc độ axit). Dung dịch ở pH 4 có độ axit cao gấp 10 lần dung dịch ở pH 5. Dung dịch ở pH 4 có độ axít cao gấp 100 lần dung dịch ở pH 6 và 1,000 lần axit hơn dung dịch ở pH 7.
Ứng dụng của pH
Giám sát pH rất cần thiết trong nhiều ứng dụng. Sự thay đổi về hóa học của hệ thống tự nhiên sẽ tác động làm thay đổi giá trị pH, sự thay đổi về pH có thể ảnh hưởng đến các hóa chất khác nhau. Ví dụ, pH ảnh hưởng đến:
- Độ hòa tan kim loại (nhiều kim loại hòa tan ở pH thấp hơn – đây là một phần của vấn đề với mưa axit)
- Sự ăn mòn (nước có tính ăn mòn ở pH thấp)
- Keo tụ và tạo bông
- Hoạt động sinh học
Phương pháp đo pH trong phòng thí nghiệm và đi hiện trường
Giấy pH
Giấy quỳ là loại giấy pH quen thuộc nhất. Nó được dùng để kiểm tra xem một dung dịch có tính axit hay bazo, với 3 loại – đỏ, xanh dương và trung tính. Quỳ đỏ chuyển thành xanh dương trong dung dịch kiềm, quỳ xanh chuyển thành đỏ trong dung dịch axit, và quỳ trung tính (thường là tím) chuyển sang màu đỏ trong dung dịch axit và xanh dương trong dung dịch có tính kiềm.

Que thử pH – hãng Hach
Để xác định độ pH cụ thể của một mẫu, sử dụng giấy thử pH (pH test paper) hoặc que thử pH (pH test strip) sẽ có độ chính xác cao hơn giấy quỳ.
Ưu điểm:
- Nhanh chóng và dễ sử dụng.
- Ít tốn kém.
- Dễ dàng mang đi hiện trường, dễ bảo quản.
Màu sắc và độ đục của dung dịch vẫn là một sự ảnh hưởng đến kết quả. Một dung dịch không màu cho kết quả tốt nhất.
Chỉ thị màu
Chỉ thị axit – bazo lỏng là các axit hoặc bazo hữu cơ yếu. Một chỉ thị có dải pH cụ thể mà sẽ thay đổi từ dạng axit sang dạng bazo. Một chỉ thị không hữu ích ngoài dải pH của nó vì chỉ thị không thay đổi màu trên các giá trị pH này.
Một số chỉ thị pH: phenolphthalein (dải pH 8.2 đến 10.0; không màu đến hồng), bromthymol xanh (dải pH 6.0 đến 7.6; vàng đến xanh dương), và quỳ (dải pH 4.5 đến 8.3; đỏ đến xanh dương).
Các chỉ thị phổ biến là hỗn hợp của các chỉ thị pH khác nhau để mở rộng phạm vi pH mà chúng hoạt động.

Chất thử chỉ thi pH – hãng Hach
Chỉ thị lỏng đặc biệt hữu ích trong các phép chuẩn độ axit – bazo, trong đó sự thay đổi pH đáng chú ý xảy ra gần điểm tương đương, bằng cách chọn một chỉ thị pH có dải pH nằm trong sự thay đổi pH của phản ứng.
Các chỉ thị pH cũng thường được sử dụng để kiểm tra nhanh các mẫu nước (nước hồ, nước bể bơi, nước uống). Phương pháp này nhanh chóng, rẻ tiền và dễ dàng.
Nhược điểm:
- Mẫu thử phải khá không màu để nhìn thấy rõ sự thay đổi màu sắc của chỉ thị.
- Chỉ thị pH vốn có độ chính xác không cao.
Phương pháp điện hóa
Hai phương pháp trên chỉ đưa ra ước tính giá trị pH mà không cho kết quả chính xác. Khi cần đo kết quả chính xác, phương pháp duy nhất có thể sử dụng là phương pháp điện hóa.
Thiết bị đo pH đo pH bằng cách đo sự khác biệt điện thế giữa điện cực pH và điện cực tham chiếu. Máy đo sau đó chuyển đổi giá trị điện thế sang kết quả pH.
Thiết bị đo pH cầm tay rất thích hợp với việc đo đạc tại hiện trường. Thiết bị đo pH để bàn thường chính xác hơn và cung cấp nhiều tùy chọn cho phép đo hơn.

Dòng máy đo HQd và điện cực của Hach
Trong các phương pháp trên, phân tích bằng phương pháp điện hóa có độ chính xác cao nhất, có thể áp dụng cho nhiều loại mẫu, cả các chất lỏng có màu, đục và thậm chí cả chất rắn.
Phép đo pH bằng phương pháp điện hóa
Nguyên lý đo
Một điện cực chỉ thị, còn được gọi là điện cực thủy tinh được sử dụng để đo pH. Điện cực thủy tinh này chứa đầy dung dịch đệm pH (pH khoảng 7).

Điện thế do điện cực tạo ra tương ứng với chênh lệch pH giữa các dung dịch bên trong và bên ngoài. Điện thế phụ thuộc vào sự chênh lệch nồng độ H+ ở hai bên của màng thủy tinh (khi cả hai mặt đều ngậm nước). Điện thế của điện cực chỉ thị thay đổi theo nồng độ H+ trong dung dịch ngoài. Khi đo pH, điện thế của điện cực thủy tinh thay đổi theo nồng độ H+.
Một điện cực thứ hai, được gọi là điện cực tham chiếu/ điện cực so sánh, được sử dụng. Điện thế của điện cực này phải ổn định nhất để có thể đo được sự khác biệt điện thế, phản ánh nồng độ H+. Đo pH, tức là đo điện thế khác biệt.

Các cấu hình điện cực đo pH
Cặp điện cực thông thường
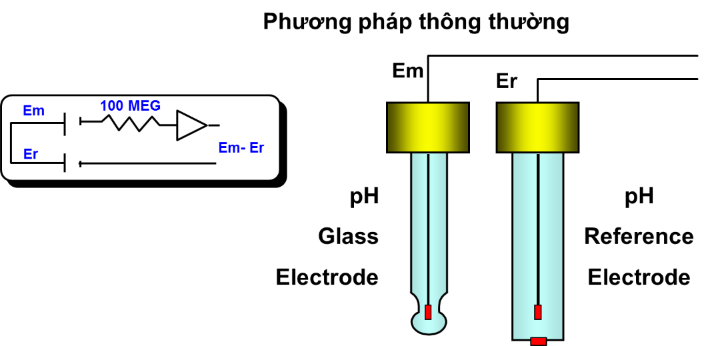
Biểu đồ trên mô tả một hệ thống pH thông thường. Nó còn được gọi là cặp điện cực. Phép đo này được thực hiện ở trở kháng rất cao. Do đó, điều cần thiết là máy đo pH có trở kháng bên trong cao, để không “kéo xuống” điện thế millivolt được tạo ra bởi các điện cực. Cáp điện cực tối đa 15–20 m.
Điện cực kết hợp
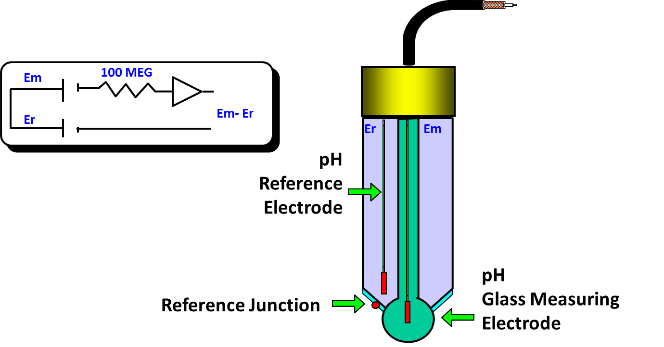
Điện cực kiểu kết hợp là loại điện cực pH được sử dụng phổ biến nhất, được sử dụng trong cả phòng thí nghiệm và ứng dụng đo trực tuyến. Trong một điện cực kết hợp, các điện cực đo và tham chiếu được nối với nhau.
Cell tham chiếu bao gồm một dây bạc / bạc clorua ngâm trong một chất điện phân thường là KCl.
Điện cực đo, là bầu thủy tinh tròn mà bạn nhìn thấy ở dưới cùng của điện cực, có một kính nhạy ion đặc biệt để tìm kiếm ion hydro. Tất cả các thành phần này được đặt trong một cấu hình duy nhất.
Các điện cực kết hợp thường không thay thế được. Nếu điện cực tham chiếu bị nhiễm bẩn thì sẽ phải thay toàn bộ điện cực.
Các vấn đề thường gặp với điện cực thủy tinh:
- Xuất hiện lớp phủ màng tùy thuộc vào ứng dụng. Khi lơp phủ màng bắt đầu xuất hiện, tốc độ phản hồi cũng như độ chính xác sẽ giảm. Lớp phủ màng xuất hiện từ độ cứng của nước, dầu, và hóa chất.
- Một vấn đề khác là phản hồi chậm do trở kháng điện cao được tạo ra bởi điện cực thủy tinh.
- Các quá trình nhớt và bùn sẽ làm suy giảm điện cực gây nên các lỗi phép đo và mài mòn bầu thủy tinh và cuối cùng dẫn đến vỡ.
- Loại bỏ điện cực từ một quá trình nóng và đặt nó vào nước lạnh để làm sạch, hoặc bộ đệm để hiệu chuẩn, làm cho điện cực bị sốc hoặc thậm chí nứt và vỡ. Thời gian phải đủ để cho điện cực đến trạng thái cân bằng nhiệt độ.
- Đưa điện cực từ một quá trình nóng và đặt nó vào nước lạnh để làm sạch, hoặc dung dịch đệm để hiệu chuẩn, làm điện cực bị shock nhiệt, hoặc thậm chí bị nứt vỡ. Cần thời gian đủ để điện cực đạt đến cân bằng nhiệt độ.
Các vấn đề thường gặp với điện cực tham chiếu:
- Chỗ liên kết có thể bị tắc với kết tủa hoặc nó có thể bị hòa tan bởi axit hoặc chất ăn mòn.
- Chất điện phân có thể bị nhiễm tạp chất bì quá trình thấm vào trong buồng. Dây Ag/ AgCl có thể bị ăn mòn bởi quá trình này.
- Nếu có một vòng lặp nối đất, nó sẽ đi theo đường của điện trở ít nhất để nối đất qua điện cực tham chiếu và có thể dẫn đến sai số pH lên đến 1 trong phép đo pH.
Vì những lý do trên, điện cực tham chiếu chiếm tỷ lệ sai sót cao trong quá trình đo pH.
Hiệu chuẩn
Khi sử dụng máy đo pH, chúng ta không nhìn thấy kết quả đọc là mV, chúng ta sử dụng kết quả đọc trực tiếp với đơn vị đo pH. Đường hiệu chuẩn cho phép máy đo chuyển giá trị điện thế sang pH. Do những thay đổi trong chức năng của điện cực pH có thể xảy ra trong một khoảng thời gian ngắn, máy đo pH phải được người dùng hiệu chuẩn thường xuyên. Tốt hơn hết là hiệu chuẩn hàng ngày.
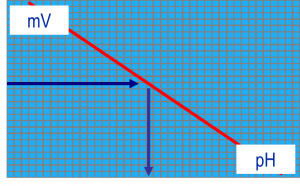
Có một mối quan hệ tối ưu giữa mV và pH (độ dốc của hiệu chuẩn). Độ dốc tối ưu là -59.16/ pH (tại 25 °C. Độ lệch chấp nhận là +/- 5% hay 3 mV.
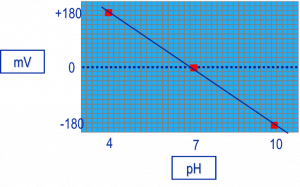
Các giá trị mV từ các dung dịch đệm 4, 7 và 10 được vẽ trên biểu đồ mV – pH. Một đường thẳng được vẽ giữa các điểm và độ dốc được xác định. Giá trị mV thực tế sẽ nhỏ hơn 180. -180 mV độ chênh lệch giữa pH4 và pH7. pH4 và pH7 (3 đơn vị pH) là nồng độ thay đổi 1,000 lần. Thập phân bằng thay đôi gấp 10 lần = 1 đơn vị pH. -180/3 = -60 » -59.16 mV/decade.
Hiệu chuẩn 1 điểm:

Hiệu chuẩn 2 điểm:
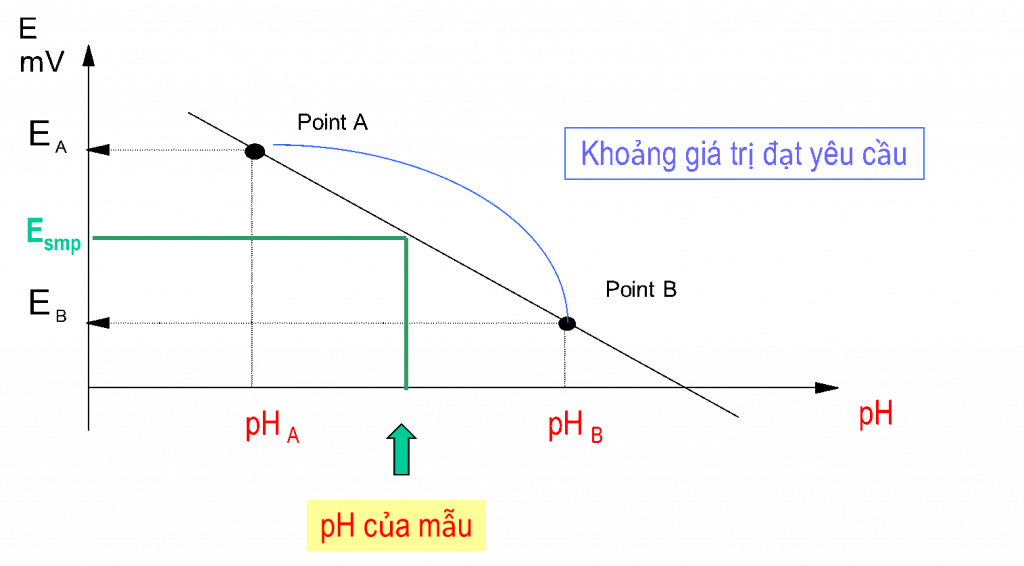
Đo pH của mẫu:
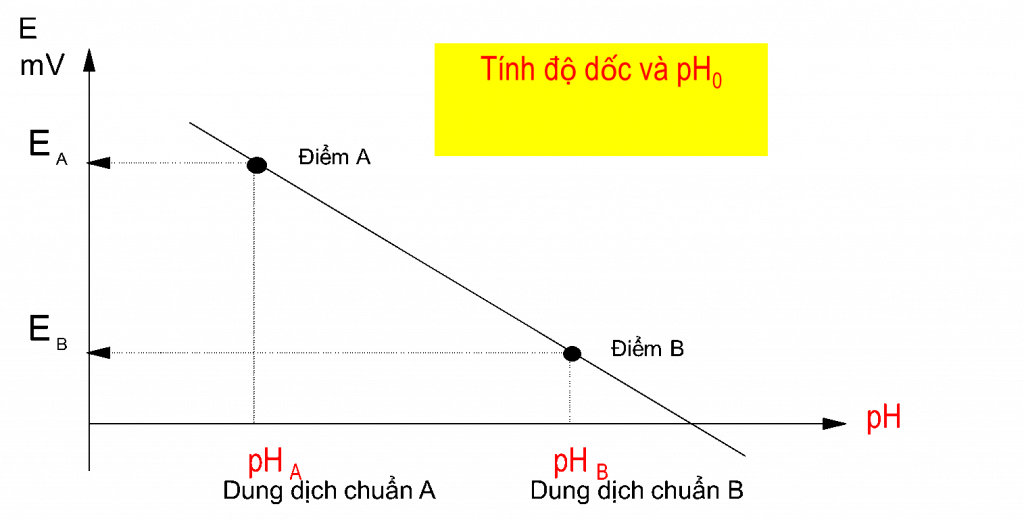
Kết quả hiệu chuẩn thứ nhất là giá trị pH0. pH0 là giá trị mà tại đó điện thế bằng 0 mV.
pH0: Giá trị pH ó E = 0 mV
Thông thường, giá trị pH này là gần 7. Đối với hầu hết các điện cực phân tích Radiometer giá trị này là 6.65 ± 0.5. Giá trị pH0 của mỗi model điện cực được viết trên hộp điện cực (X). pH0 cho biết thông tin về chuỗi đo (các thành phần tham chiếu của điện cực, cầu nối chất lỏng,..). Sau khi hiệu chuẩn, kết quả pH0 phải gần bằng với giá trị ban đầu: pH0 = X ±0.1.
Nếu độ sai lệch pH0 cao (trên 0.1 pH), điện cực cần được kiểm tra lại.
Trog máy đo pH: 6 < pH0 < 7.5. Nếu giá trị pH0 từ hiệu chuẩn không nằm trong khoảng này, kết quả hiệu chuẩn sẽ bị loại bỏ.
Kết quả hiệu chuẩn thứ hai là độ dốc:
Độ dốc tương ứng với sự biến thiên điện thế được đo ở độ biến thiên lý thuyết. Nếu giá trị pH thay đổi 1 đơn vị có nghĩa là biến thiên điện thế 59.16 mV. Điều đó cũng có nghĩa là độ dốc 100% tương ứng với 59.16 mV ở 25 °.
Giá trị độ dốc lý tưởng là 100%. Độ dốc cho biết dấu hiệu về chất lượng của màng thủy tinh. Nếu độ dốc dưới 95%, điện cực đang trong tình trạng xấu.
Trong một số máy đo của Hach, giá trị độ dốc phải nằm trong khoảng từ 95% đến 102% nếu không thì kết quả hiệu chuẩn sẽ bị loại bỏ. Đối với một số khác, tham số này có thể điều chỉnh được.
Độ dốc và pH0 cung cấp thông tin về điện cực được sử dụng. Các giá trị của những tham số này thay đổi theo thời gian. Do đó, cần phải thường xuyên hiệu chuẩn.
Hãy liên hệ với chúng tôi – CÔNG TY CỔ PHẦN VISTECH – NHÀ PHÂN PHỐI ĐƯỢC ỦY QUYỀN CỦA HÃNG HACH TẠI VIỆT NAM theo số điện thoại: (024) 3566 7886, (024) 3566 7887 hoặc email: vistechco@fpt.vn để được tư vấn đầy đủ nhất.

máy này có đo được dòng chảy liên tục và đo trong môi trường độ dẫn điện dưới 10 μS/cm
cty mình cần lắp vào NH3 tự động để điều chỉnh pH