Phần 1: Nguyên lý và các phương pháp đo độ cứng
Nguyên lý
Độ cứng của nước là một thước đo hàm lượng khoáng chất trong nước. Cụ thể, độ cứng là tổng của các chất tan đa hóa trị trong nước – canxi, magiê, sắt, nhôm, mangan, stronti và kẽm. Trong số này, canxi và magiê (Ca2+, Mg2+) đóng góp đáng kể nhất đối với độ cứng của nước do lượng lớn của chúng trong môi trường. Cần chú ý khi các cation khác góp phần vào độ cứng với số lượng đáng kể. Giặt bằng nước cứng rất tốn xà phòng vì nước cứng làm kết tủa gốc axit trong xà phòng và làm xà phòng không lên bọt.
Độ cứng của nước (chủ yếu là hợp chất của canxi và magie) được phân loại thành độ cứng cacbonat và độ cứng phi cacbonat.
Độ cứng carbonat (thường ký hiệu là CH: Carbonate Hardness) là độ cứng gây ra bởi hàm lượng Ca2+, Mg2+ tồn tại dưới dạng HCO3-. Độ cứng carbonat còn được gọi là độ cứng tạm thời vì nó có thể được giảm bằng nhiều phương pháp đơn giản.
Độ cứng phi carbonat (thường ký hiệu là NCH: Non- Carbonate Hardness) là độ cứng gây ra bởi hàm lượng Ca2+, Mg2+ liên kết với các anion khác HCO3- như SO42-, Cl-,… Độ cứng phi carbonat còn được gọi là độ cứng vĩnh cửu.
Các phương pháp đo độ cứng của Hach hoặc là phân tích độ cứng canxi hoặc là độ cứng tổng số (canxi và magiê). Các đơn vị nồng độ có thể được thể hiện bằng nhiều cách. Chúng thường được thể hiện tương đương với nồng độ calcium carbonate (CaCO3). Độ cứng canxi cacbonat là một thuật ngữ chung cho biết tổng lượng khoáng hóa trị hai có mặt và không xác định cụ thể cho dù canxi, magiê và/hoặc một số muối hóa trị hai khác đang gây ra độ cứng của nước. Về lý thuyết, có thể có nước với độ cứng cao biểu diễn như CaCO3 mà không chứa canxi.
Các phản ứng hóa học
Các phương pháp chuẩn độ
Độ cứng trong nước có thể được xác định một cách nhanh chóng bằng cách chuẩn độ và sử dụng các chỉ thị màu sắc. Bằng cách lựa chọn đúng pH, tổng độ cứng (Ca2+ và Mg2+) hoặc là một phần đóng góp của canxi, magiê riêng lẻ có thể được đo. Các phân tích độ cứng thông thường liên quan đến việc điều chỉnh pH đến 10.1 với đệm amoni, bổ sung chỉ thị Eriochrome đen T [1- (1- hydroxy-2-naphthyl azo) 6-nitro-2-naphthol-4-sulfonic axit] và sau đó chuẩn độ với dung dịch Na2EDTA (axit ethylenediaminetetraacetic, muối dinatri).
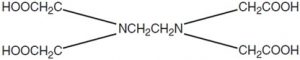
Cấu trúc hóa học của EDTA
Một số chỉ thị khác bền hơn, đưa ra phản ứng nhanh hơn và điểm kết thúc dễ phân biệt hơn Eriochrome đen T. Một trong những chất tốt nhất là calmagite, 1- (1-hydroxy-4-methyl-2-phenylazo) -2-naphthol-4 sulfonic axit, được sử dụng trong các phân tích tổng độ cứng của Hach. Calmagite có lợi thế là hình thành dung dịch bền vững vô thời hạn.
Phản ứng hóa học chuẩn độ Độ cứng tổng
Chỉ thị Calmagite có sẵn trong công thức đặc biệt như ManVer ™ – đặc biệt được chuẩn bị để tăng cường sự ổn định và ít bị tác động bới chất gây nhiễu nhất. Phản ứng của calmagite phụ thuộc pH; độ pH lý tưởng là 10.1. Thông thường, đệm amoniac được sử dụng; Tuy nhiên, chúng có mùi mạnh. Phương pháp của Hach sử dụng Hardness 1 Buffer (2-amino-2-methyl-1-propanol), ổn định, an toàn để sử dụng và ít mùi.
Trình tự phân tích trong các phân tích độ cứng bắt đầu với điều chỉnh pH và bổ sung các chất ức chế theo sau sự hình thành phức của Mg2+ và Ca2+ với calmagite. Canxi tạo thành một phức hợp yếu với calmagite ở pH này. Các dung dịch được chuẩn độ với TitraVer (EDTA). Các chất thử chuẩn đầu tiên tạo phức canxi, sau đó magiê. Thay đổi màu sắc từ đỏ rượu vang sang màu xanh là một chỉ thị cho thấy tất cả canxi và magiê đã được loại bỏ khỏi calmagite và tạo phức với thuốc thử.
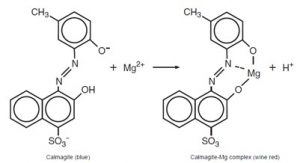
Phản ứng giữa magie và chỉ thị calmagite
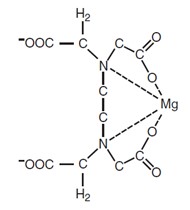
Magie tạo phức với TitraVer
Biểu thị kết quả của sự phếp chuẩn độ độ cứng là mg /L theo CaCO3. Phản ứng của TitraVer với Ca2+ và Mg2+ theo một tỉ lệ 1: 1.
Phản ứng hóa học chuẩn độ Độ cứng Canxi
Các phân tích cho độ cứng canxi rất giống với phân tích độ cứng tổng. Thông thường, hoặc là chỉ thị murexide (amoni purpurate) hoặc chỉ thị Eriochrome xanh đen R theo sau là chuẩn độ với EDTA. CalVer 2 Calcium Chỉ thị được phát triển bởi Hach để thay thế các chỉ thị này. CalVer 2 (hydroxy naphthol xanh) là nhạy hơn và có một điểm kết thúc thay đổi màu sắc nét hơn.
Chỉ thị CalVer 2 Calcium hình thành phức màu tím đỏ với canxi và chuyển sang màu lam sau khi TitraVer loại bỏ canxi từ phức. Việc điều chỉnh pH được thực hiện bởi bổ sung kali hydroxit trước khi bổ sung CalVer 2. Kali xyanua cũng có thể được thêm vào đê tạo phức với kim loại gây nhiễu.
Độ cứng canxi và độ cứng tổng có thể được xác định liên tiếp bằng cách sử dụng cùng một mẫu. Sau khi độ cứng canxi được xác định pH mẫu có thể được điều chỉnh xuống, sử dụng axit sulfuric. Sau đó Hardness Buffer 1 và ManVer 2 được bổ sung và phép chuẩn độ với TitraVer được thực hiện.
LƯU Ý: KHÔNG sử dụng quy trình này nếu kali xyanua đã được sử dụng trong việc xác định độ cứng canxi! Việc bổ sung các axit sulfuric sẽ gây chết người do khí hydrogen cyanide hình thành.
Các phương pháp so màu
Phương pháp so màu được sử dụng để đo độ cứng thang thấp. Chỉ thị Calmagite và hai tác nhân tạo phức càng cua, EGTA và EDTA, được sử dụng trong các phân tích.
Phản ứng hóa học so màu calmagite
Calmagite, chứa trong dung dịch chỉ thị canxi và magie, được thêm vào một mẫu và pH được nâng lên khoảng 12.5 bằng cách sử dụng đệm. Thêm calmagite trước khi điều chỉnh pH ngăn cản canxi và magiê kết tủa – thường sẽ xảy ra ở pH cao này. Sau đó mẫu được chia thành ba phần bằng nhau.
EDTA được thêm vào phần đầu tiên để cô lập canxi và magiê, qua đó phá vỡ phức Ca và Mg-calmagite. Dung dịch này được sử dụng như một mẫu trắng zero tham chiếu của chuẩn hoá máy quang phổ.
EGTA hoặc ethylene glycol-bis (2-aminoethyl ether) -N, N, N ‘, N’-axit tetraacetic, được thêm vào phần mẫu thứ hai. EGTA chọn lọc tạo phức càng cua canxi trong điều kiện của phân tích; chỉ có phức Mg-calmagite còn lại được đo. Kết quả được thể hiện như mg/L Mg là CaCO3. Sau phép đo, máy quang phổ được điều chỉnh để đọc “zero” vào phần này.
Độ hấp thụ của phần mẫu thứ ba (không chứa chất càng cua) được đo để xác định mg/L Ca CaCO3. Điều chỉnh máy quang phổ để kết quả đọc zero sau phép đo phần mẫu thứ hai để bù độ hấp thụ do magiê trong mẫu.
![]()
Cấu trúc hóa học của EGTA
Phản ứng hóa học so màu chlorophosphonazo
Canxi và magiê kết hợp tương đương với chỉ thị Chlorophosphonazo III để tạo thành một phức màu mà hấp thụ ánh sáng rất mạnh ở 669 nm. Một giọt thuốc thử CDTA (axit cyclohexanediaminetetraacetic, muối dinatri) phá vỡ phức này và mức giảm màu sắc tỷ lệ thuận với lượng canxi và magie trong mẫu (CaCO3). Kết quả phân tích được đo ở 669 nm.
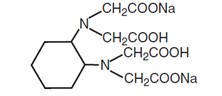
Cấu trúc hóa học của CDTA
Nguồn tham khảo:
Website: www.hach.com
